设想一下,我们让一个生物科研的同学来从头设计一个人质膜蛋白阵列技术,需要解决的问题有哪些?第一,膜蛋白基因库应该包含哪些,Uniprot是蛋白分析领域大家最熟知的数据库,但是如果以膜蛋白分类,虽会获得一定的基因信息,但还会涉及到衍生、这些基因如何获得、多亚基膜蛋白的设计问题等等;第二,这些基因如何批量递送到工具细胞中,大规模批量平行转染的技术需要过硬,由此衍生的问题还包括转染质粒库的搭建和维护问题;第三,如何确认转染的质粒能正确表达在工具细胞的细胞表面,做过实验的同学都知道,递送几个基因尚存在转染效率不一致的难题,如此大量的基因表达和确认工作属实有点挠头;第四,如何选择一种准确且高灵敏、高通量的检测手段,又如何确保检测方法的稳定性和重复性;第五,也是最关键的,都说质量源于设计,因此如何设计准确可信的质控方案,包括关键实验对照设计,质控点的设置,假阳性和假阴性的判定,筛选结果的解读和确认等等。以上问题都解决了之后,别忘记了,还有一个数量级的问题,数千个基因和我们常规遇到的数十、数百的基因遇到的困难,显然不可同日而语。
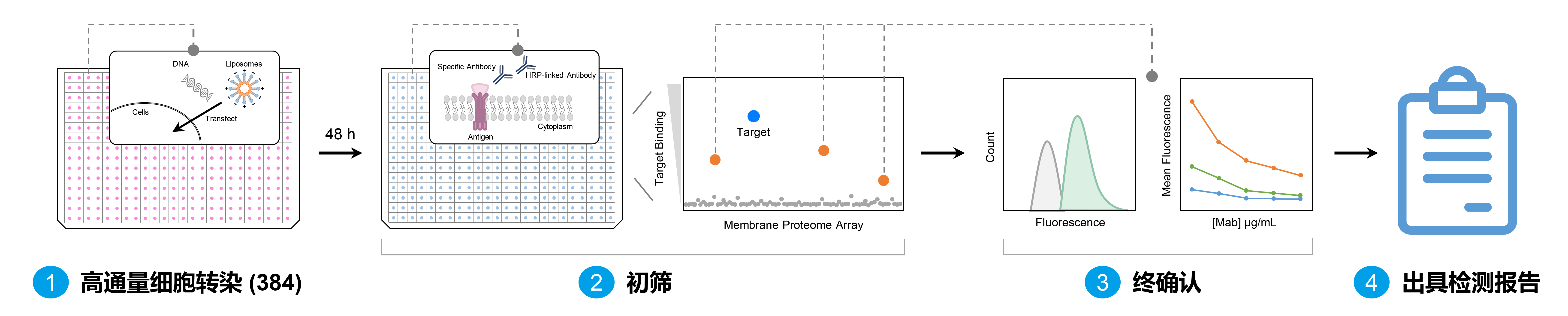
图1 人质膜蛋白阵列平台抗体特异性分析
可以看到搭建人质膜蛋白阵列存在上面的诸多难点,为什么还需要费劲开发这样的技术,然后它为什么在生物药方面这么被重视呢?人质膜蛋白阵列技术究竟可以解决哪些现行技术无法解决的难题?
回到篇首的问题,人质膜蛋白阵列技术之所以悄然出现在CDE的征求意见稿中,而且从目前了解到的生物新药IND申报情况来看,该检测也是CAR-T产品申报基本必须提交的一个关键数据,其核心考量还是针对药品的安全性,尤其是脱靶毒性的问题。CAR-T产品作为一个“活的药物”,从已报道的数据来看,其杀伤肿瘤的功能是已知药物中排名非常靠前的,所以“大杀器”对准星准确度的要求也必然更高。而无论是CAR-T或者抗体药,其准星就是抗体的抗原识别区。其实在人质膜蛋白阵列技术出来之前,为了检测抗体以及CAR-T药物的脱靶风险的方法是人组织交叉实验(TCR)。虽然这项技术至今仍然是上述药品申报的必选项,但是该技术本身具有无法克服的弊端【REF】(这里埋个瓜,我们后面的文章再具体对比这两种技术)。除了评价CAR-T或者抗体药品的脱靶风险,其实人质膜蛋白阵列技术的应用场景还很多,包括:生物药的早期筛选,病毒感染机制研究,配受体脱孤等等。后续如果有机会我们再聊。在靶点开发早期,如果想利用人质膜蛋白阵列技术对我们筛选的抗体(或者)进行一下安全性体检,避免后期研发失败。或者CDE要求必须开展这项检测,应该怎么入手?如果你选择目前英国和美国的人质膜蛋白阵列检测服务,你可能需要先了解:第一步、联系美国或者英国对应服务公司的销售,明确检测要求,签订合同;第二步、准备样本,明确送样要求,样本的类型和样本量,寄送方式;第三步、样本出口(没有看错),联系海关进行相关的报批手续,联系冷链公司进行跨境运输(价格感人);第四步、国外机构开展预实验对样本的适用性进行评估,随时准备好根据实验结果做好重新送样;第五步、开展正式检测,以及后面的终确认。两家机构都是采用分期付款的模式,中间需要做好跨境付款的相关手续,这个就不再赘述了。当然国内目前也有一些代理,可以帮忙进行沟通、出口等联系,代价就是多付一点服务费。另外需要提醒的是,这里除了付出的金钱成本,另一个更大的成本,实际上是在于时间成本,所以一定需要预留足够多的时间来开展这项检测。悄悄的告诉你,除了国际上两家机构之外,国内也有一家机构可以开展该项检测服务,成立于2019年的科技(重庆)有限公司,在CDE发布征求意见稿之前开始布局该技术,从头搭建了自主知识产权的人质膜蛋白阵列检测技术,通过4年多的埋头建设,近日重磅推出了国际领先的蛋⽩特异性验证的人质膜蛋白阵列平台,提供“⼀站式、⼀体化”的蛋⽩⾮特异性筛选服务,成为了全球第三家可开展此技术服务的公司。目前守衡生物已自发完成了多例已上市的单克隆抗体脱靶性研究,已和多家头部生物医药公司建立了战略合作关系,且提供的检测数据报告已通过了IND申报,获得默示许可,从而解决样品国外送检时间久,沟通成本高等一系列问题,助力研发团队的研发进程和IND申报加速,减少在研发和临床实验中的投入风险。